§醫策會人體研究倫理審查委員會暨受試者保護查核作業
一、受試者保護中心成立:
院長於2022年5月6日核定本院成立受試者保護中心(高總人字第1111008111號)。本院為保障臨床研究受試者之安全、權益與福祉,在「受試者保護諮議委員會」督導下,設立「受試者保護中心(Human Research Protection Center, HRPC)」,透過與本院「人體研究倫理審查委員會(Institutional review board, IRB)」之合作,整合「教學研究部部臨床試驗科」、「藥學部臨床試驗藥局」、「輻射防護管理委員會」、「生物安全委員會」等單位共同合作,提升對全院臨床研究受試者之保護與臨床試驗品質。
受試者保護中心主任為陳理維教授。
【組織架構圖】
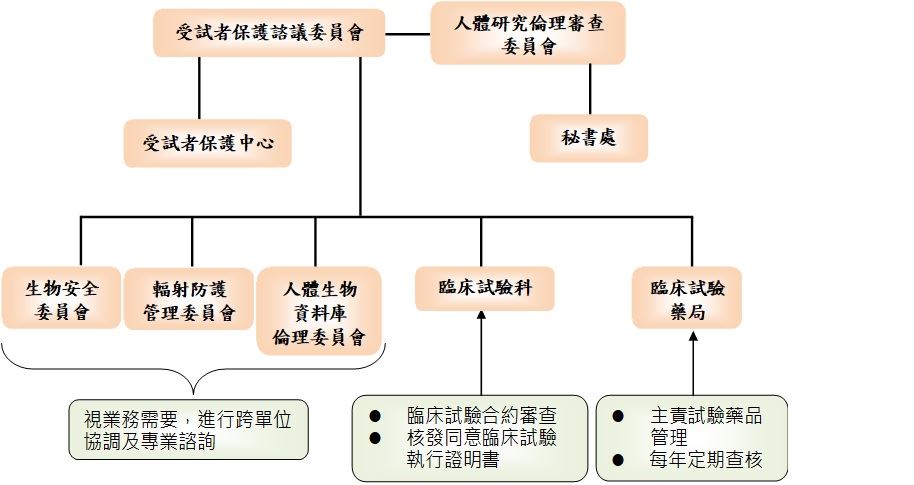
二、委託本院人委會審查人體研究計畫之機構,對機構內之受試者保護政策應與本院一致(簽訂代審合約之機構,亦視同同意本院受試者保護政策)。
| 項目 |
內容 |
權責 |
| 6.1 |
訂定受試者保護政策與SOP
(辦理倫理審查、試驗藥品管理、臨床試驗合約審查、教育訓練、內部稽核等。) |
本院(受試者保護中心)
(因代審機構皆無臨床試驗藥品及醫療器材計畫,故6.5項不適用) |
| 6.2 |
定期落實評估受試者保護工作情形 |
| 6.3 |
本院IRB建立管理利益衝突的程序且落實 |
| 6.4 |
設立諮詢窗口供機構內與機構外人士對受試者保護工作提供申訴、建言或諮詢 |
| 6.5 |
研究機構對於臨床試驗藥品及醫療器材有效管理 |
| 6.1~6.4 |
配合上述政策 |
委託代審機構 |
三、諮詢申訴管道:
| 「本專區提供不同的對象(如:研究受試者及其家屬、一般民眾、研究人員、IRB委員)申訴及諮詢管道」 |
| 對象 |
問題 |
聯絡窗口 |
管道 |
研究受試者
及其家屬 |
參與研究或試驗後,發生任何不適情形時;或對該研究計畫內容有疑問。 |
計畫主持人
或研究護士 |
請參閱研究或試驗計畫的「受試者同意書」第一頁,內容有24小時緊急聯絡人或計畫主持人的聯絡電話或方式。 |
| 臨床試驗科 |
聯絡電話:07-3422121#71635/臨床試驗科
電子信箱e-mail:jitsaic@vghks.gov.tw
|
| 對研究的相關權益或對研究團隊有疑問。 |
人體研究倫理審查委員會
(IRB) |
聯絡電話:07-3422121#71585/IRB梁承辦人
聯絡時間:週一至週五8:00~12:00、13:30~17:30
電子信箱e-mail:irb@vghks.gov.tw |
|
受試者保護中心
|
聯絡電話:07-3422121#71591/HRPC汪承辦人
聯絡時間:週一至週五8:00~12:00、13:30~17:30
電子信箱e-mail:wyhsuan@vghks.gov.tw
|
| 一般民眾 |
查詢有哪些研究試驗案或諮詢如何參與研究。 |
|
1. 台灣臨床試驗資訊平台
2. 查詢本院正在執行中之臨床試驗案網址(連結)
|
| 研究人員 |
計畫申請之諮詢與輔導 |
人體研究倫理審查委員會
(IRB) |
聯絡電話:07-3422121#71585/IRB梁承辦人
聯絡時間:週一至週五8:00~12:00、13:30~17:30
電子信箱e-mail:irb@vghks.gov.tw |
IRB的委員
或工作人員 |
受到研究機構、主持人、申請人脅迫或不當影響之事件 |
人體研究倫理審查委員會
(IRB) |
聯絡電話:07-3422121#71585/IRB梁承辦人
聯絡時間:週一至週五8:00~12:00、13:30~17:30
電子信箱e-mail:irb@vghks.gov.tw |
四、如試驗計畫有人員異動應依規定提送計畫修正案,詳參附件。附件:公文。
五、本院受試者保護中心提供本院同仁(含分院)及本院代審人體研究計畫機構受試者保護相關諮詢申訴管道,詳參附件。附件:公文。
六、受試者保護宣導手冊:
1.衛福部受試者保護宣導手冊-受試者版
2.衛福部受試者保護宣導手冊-研究人員版
七、受試者保護訊息(附件)。
八、臨床試驗廠商研究計畫助理向院方申請實名卡應先會辦本院受試者保護中心(公文)。
九、本院非廠商贊助之人體試驗計畫主持人登錄Clinical Trials參考資料(附件)。
十、有關本院非廠商贊助之人體試驗計畫如經人委會議會議決議需送審衛福部,請計畫主持人先通過IRB審查(取得IRB同意函及計畫編號)後,再與受試者保護中聯繫辦理後續送審衛福部事宜(公文)。
十一、參加藥品臨床試驗須知道的事(DM)。